Masa atòmica
Es la cantidad de materia de un elemento.
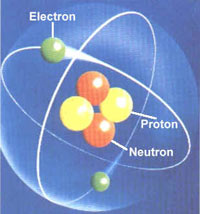 |
| Masa atómica: protones más neutrones. |
Todos los aspectos cuantitativos de la química descansan en conocer las masas de los compuestos estudiados.
Conceptualmente, masa atómica (m. a.) es la masa de un átomo, y la masa de un átomo en particular es la suma de las masas de sus protones y neutrones, y varía en los distintos isótopos.
Sabemos que los átomos de elementos distintos tienen distinta masa entre sí. Por ejemplo, un átomo de hidrógeno tiene distinta masa que un átomo de cobre. El átomo de cobre tiene más masa; por lo tanto, pesa más que el átomo de hidrógeno (tiene mayor peso atómico).
Los átomos son tan pequeños que no podemos medir (pesar) la masa de un átomo individualmente. No existe una balanza capaz de medir la masa de un solo átomo.
Tampoco es posible contar los átomos necesarios para ajustar una deterrminada combinación o reacción química entre elementos distintos.
Pero lo que sí sabemos es que existe el concepto de mol, el cual representa un número definido de átomos.
Un mol se define como la cantidad de materia que tiene tantas unidades como el número de átomos que hay en exactamente 12 gramos de 12C.
Se ha demostrado que este número es: 6,0221367 x 1023
Se abrevia como 6,02 x 1023, y se conoce como número de Avogadro.